Long Covid als Autoimmunerkrankung des Nervensystems
Antikörper von manchen Personen mit Long Covid richten sich gegen Strukturen des Nervensystems und können bei Mäusen Long Covid-Symptome auslösen.

Die wichtigsten Punkte auf einen Blick
- Zwei voneinander unabhängige Studien identifizierten bei Long Covid-Kranken mit neurologischen Symptomen eine Reihe von Autoimmunantikörpern.
- Die experimentelle Gabe dieser Antikörper führt bei Mäusen zu mit Long Covid vergleichbaren Symptomen.
- Long Covid ist offensichtlich keine psychische oder psychosomatische Erkrankung, auch wenn manche - aus dem medizinischen Betrieb - dies behaupten.
In den letzten Wochen sind zwei bereits recht breit rezipierte Preprints von ähnlichen Studien erschienen. In beiden geht es um die Identifikation von Autoantikörpern - also Antikörpern, die sich fälschlich gegen körpereigenes Gewebe richten - und neurologische Symptome von Long Covid - vom sprichwörtlichen Brain Fog bis zu Kopfschmerzen und Gedächtnisstörungen.
Preprints sind wissenschaftliche Fachartikel, die noch nicht von unabhängigen Experten einem Reviewprozess unterzogen worden sind. Normalerweise versuche ich solche Artikel hier zu vermeiden, weil sie Fehler enthalten können, die für jemanden, der nicht sehr tief in die jeweilige Materie eingearbeitet ist, kaum zu entdecken können.
In diesem Fall mache ich eine Ausnahme. Ein Preprint stammt nämlich von einer Forschungsgruppe um die Yale-Immunologin Akiko Iwasaki, eine der profiliertesten Grundlagenforscherin zu Long Covid. Im April wurde sie vom Time Magazine zu einer der 100 einflussreichsten Personen des Jahres gewählt, die Würdigung schrieb immerhin Anthony Fauci. Dass eine zweite Gruppe unabhängig davon zu ähnlichen Ergebnissen gekommen ist, erhöht das Vertrauen in die Ergebnisse noch weiter.
Ein paar Vorbemerkungen
Long Covid (in der Fachliteratur oft auch Post-akute Sequelae von COVID-19 = PASC genannt) ist kein klar definierter Begriff, sondern eher ein Überbegriff für eine Reihe an Symptomen und Folgeerkrankungen, die nach einer Infektion vom SARS-CoV-2 auftreten können. Entsprechend breit gefächert und uneinheitlich sind auch die Pathomechanismen - also die zur Krankheit führenden Vorgänge im Körper. In diesem Blog bin ich schon wiederholt darauf eingegangen. Viele werden das also schon von hier oder anderswo kennen.
Es gibt verschiedene Versuche, das heterogene Long Covid in klarer fassbare Untergruppen aufzuteilen. Das ist sinnvoll, weil sich diese in ihrer Entstehung, aber auch in der Diagnostik und Therapie beträchtlich voneinander unterschieden können, teilweise sogar konträr sind. Eine einfache, praktikable Unterteilung unterscheidet drei Gruppen, die sich bei den Betroffenen auch überschneiden können. (Nichts ist einfach bei Long Covid.)
- Die nach einem oft milden Verlauf von COVID-19 auftretenden Symptome, die in die Richtung des Chronic Fatigue Syndroms gehen oder sogar dem Vollbild von ME/CFS entsprechen. In meiner Vorstellung handelt es sich dabei um das eigentliche Long Covid.
- Anhaltende Symptome durch die Gewebsschädigung nach einem meist schwereren Verlauf von COVID-19.
- Die Verschlechterung einer vorbestehenden Krankheit oder das neue Auftreten einer Folgekrankheit.
Als Ursache für Long Covid, vor allem die erste Form in der obigen Unterteilung, haben Akiko Iwasaki (wer sonst?) und David Putrino von Mount Sinai, NYC, schon vor längerem vier Pathomechanismen beschrieben:
- Ein Reservoir von SARS-CoV-2-Viren oder unvollständig produzierten Virusbruchstücken.
- Autoimmunität durch Antikörper und/oder Lymphozyten.
- Reaktivierung anderer, latenter Virusinfektionen wie EBV oder Herpes zoster.
- Gewebsschädigung durch die Infektion oder die Immunantwort. Diese kann wiederum eine Autoimmunreaktion triggern.
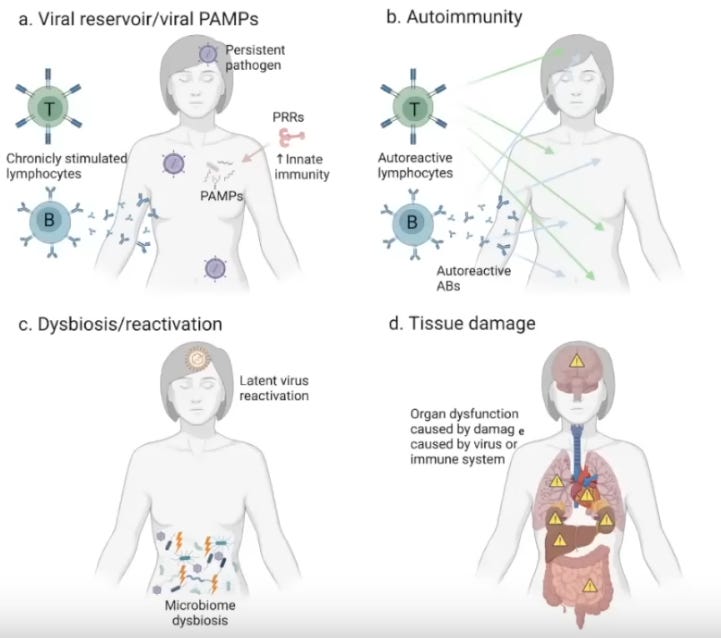
Über die neurologischen Symptome von Long Covid, ihre Häufigkeit und zugrundeliegende Pathomechanismen habe ich schon mehrmals geschrieben. Z.B. hier ("Verschmelzende Zellen und andere Dinge, die COVID-19 im Gehirn anstellen kann"), hier ("Long Covid, die Blut-Hirn-Schranke und das Immunsystem") und hier ("[Update] COVID-19 und was es mit dem Gehirn macht"). So eindeutige Hinweise für die Rolle von Autoimmunantikörpern wie in den beiden im Folgenden vorgestellten Studien sind mir bis jetzt aber noch nicht untergekommen.
Autoantikörper bei Long Covid
Nach einer Infektion mit SARS-CoV-2 ist das Risiko für eine Autoimmunerkrankung deutlich erhöht, von der rheumatoiden Arthritis über Schilddrüsenerkrankungen bis zum Diabetes mellitus Typ 1. In einer großen Studie aus Hong Kong um das eineinhalb- bis zweieinhalbfache, wobei das relative Risiko bei Geimpften wiederum um etwa ein Drittel geringer war als bei den Ungeimpften.
Aber eben auch bei Long Covid selbst gibt es zahlreiche Hinweise für eine autoimmunologische Komponente zumindest bei einem Teil der Kranken. Die Forschungsgruppe um Akiko Iwasaki identifizierte bereits 2021 eine Vielzahl an verschiedenen Autoantikörpern bei Personen nach COVID-19. Autoantikörper können nach verschiedensten Infektionen auftreten, meist ohne im Körper etwas anzustellen. Und auch völlig gesunde Menschen können Autoantikörper haben. Die antinukleären Antikörper (ANA) beispielsweise, die bei einigen der schwersten Autoimmunerkrankungen auftreten, sind auch bei rund 5% der Gesunden nachweisbar. Wie schon öfters erwähnt: In der Immunologie ist selten etwas einfach und eindeutig.
Die beiden Studien kommen der Wirkung der Autoantikörper bei Long Covid etwas näher.
Die niederländische Studie
Die erste der beiden Studien wurde vor 4 Wochen von einer Arbeitsgruppe aus Amsterdam auf einen Preprint-Server hochgeladen ("Transfer of IgG from Long COVID patients induces symptomology in mice"). 34 Personen im Alter von 18 bis 65 mit Long Covid seit mindestens 6 Monaten wurden hier genauer untersucht. Sie alle hatten einen sogenannten milden Verlauf von COVID-19 gehabt, ihre Long Covid Symptomatik ist so schwer, dass sie ihre Arbeitszeit auf zumindest Teilzeit reduzieren mussten.
Anhand von verschiedenen Blutmarkern wurden sie in 3 verschiedene Gruppen unterteilt. Gruppe 1 hatte erhöhte Marker für eine Nervenschädigung, Gruppe 2 hatte erhöhte Typ-1-Interferon-Level, wie sie vom Körper z.B. bei chronischen Virusinfektionen ausgeschüttet werden, Gruppe 3 wies keine dieser beiden Auffälligkeiten auf. Von diesen drei Gruppen sowie von einer Kontrollgruppe ohne Long Covid wurden Antikörper isoliert und Labormäusen verabreicht.
Die Antikörper der Gruppen 1 und 3 führten dazu, dass die Mäuse mechanische und thermale Schmerzreize deutlich weniger gut tolerierten. Bei Antikörpern der Gruppe 2 war das nur schwach ausgeprägt.

Mäuse waren dagegen am Tag nach der Gabe von Antikörpern der Gruppe 2 weniger körperlich aktiv und legten kürzer Strecken zurück. Davon erholten sich die Mäuse rasch.

Zusammengefasst entwickelten Mäuse nach der Gabe von Antikörpern von Long Covid-Kranken also Symptome, wie wir sie von dieser Krankheit kennen. Sie hatten aufgrund der niedrigeren Schmerzschwelle mehr Schmerzen und waren bei körperlicher Aktivität schneller erschöpft.
Die US-Studie
Die Studie mit Beteiligung von Forschungsgruppen aus Yale und Mount Sinai, NYC, wurde vor einer Woche auf einen Preprint-Server hochgeladen ("A causal link between autoantibodies and neurological symptoms in long COVID").
Hier wurden 55 Long Covid-Kranke ausgewählt, die in erster Linie neurologische Symptome wie Brain Fog, Kopfschmerzen, Gedächtnisstörungen, Schwindelgefühl und Schlafstörungen angaben. Zunächst wurde ihnen Blut abgenommen und Antikörper isoliert. Dann wurde geschaut inwiefern diese Antikörper im Labor gegen menschliches Hirngewebe sowie auch gegen Nervengewebe von Mäusen reagieren. Gegen eine Reihe dieser Proben trat eine Reaktion auf, die bei Antikörpern der gesunden Kontrollgruppe nicht gesehen wurde.
Wie in früheren Studien richteten sich die Antikörper kaum oder gar nicht gegen die Nervenzellen selbst, sondern gegen das Endothel der Kapillaren, also die immunologisch sehr aktive Innenauskleidung der kleinsten Blutgefäße, und gegen die Perizyten, die den Blutgefäßen außen anliegenden Bindegewebszellen. Die Rolle der Kapillaren bei COVID-19 bzw. Long Covid zeigt sich also auch hier.

Ähnlich wie in der niederländischen Studie wurde auch hier Labormäusen Serum von Long Covid-Patienten verabreicht. Mit ähnlichen Ergebnissen. Auch hier sank die Schmerztoleranz, vor allem bei den Mäusen, die Serum von Personen erhielten, bei denen die Schmerzen im Vordergrund standen.

Auch die Koordination und die Muskelkraft wurden durch Gabe der Antikörper verschlechtert.
Ist Long Covid eine Autoimmunerkrankung?
Zwei unabhängig voneinander durchgeführten Studien brachten also ein ähnliche Ergebnisse. Bei Menschen mit neurologischen Symptomen von Long Covid kommt ein breites Spektrum von Autoantikörpern vor, die sich gegen verschiedene Strukturen des Nervengewebes richten. Wenn man diese Antikörper Mäusen verabreicht, entwickeln diese mit Long Covid vergleichbare Symptome. Sie machen also vermutlich wirklich etwas im Körper. Wie sich diese Kenntnisse auf Menschen umlegen lassen, werden weitere Studien zeigen. Jedenfalls bieten die beiden Studie einen weiteren von vielen Hinweisen, dass Long Covid keine psychische oder psychosomatische Erkrankung ist. Denn diese würde kaum mit Serum auf Mäuse übertragbar sein.
Ob man Long Covid aber als Autoimmunerkrankung im eigentlichen Sinn bezeichnen kann ist aber eine andere Frage. Bei den meisten Autoimmunerkrankungen finden sich wenige spezifische Antikörper, deren Nachweis meist zur Routinediagnostik in der Medizin gehört. Bei Long Covid - so wie wohl auch bei manchen anderen PAIS (postakuten Infektionssyndromen) - finden sich aber eine ganze Reihe an unterschiedlichen Antikörpern. Das erklärt einerseits einen Teil der breiten Symptomatik bei Long Covid. Andererseits ist Long Covid (zumindest in meiner Vorstellung) wohl keine Autoimmunerkrankung per se, sondern mehr ein Trigger für Autoimmunität.
Was diese Erkenntnisse für die Therapie von Long Covid bedeuten, wird sich weisen. Methoden, die die Autoantikörper aus dem Blut entfernen wie z.B. die Immunapherese oder das experimentelle BC007 bringen jedenfalls bei einigen, aber nicht allen Betroffenen eine Besserung der Symptome. Immunsuppressiva dagegen, wie sie bei zahlreichen Autoimmunerkrankungen eingesetzt werden, könnten bei Long Covid ein zweischneidiges Schwert sein. Wie anfangs in diesem Artikel erwähnt, ist auch ein im Körper schlummerndes Reservoir von SARS-CoV-2 und/oder anderen Viren ein möglicher Pathomechanismus von Long Covid. Eine das Immunsystem bremsende Therapie könnte dazu führen, dass diese Viren nicht mehr unterdrückt werden und sich wieder zu vermehren beginnen. Mit entsprechenden Folgen für die Betroffenen.
Es gibt Berichte von Personen mit einer monatelang aktiven SARS-CoV-2-Infektion. Fast immer waren das Menschen, die - zum Beispiel aufgrund einer Organtransplantation - Immunsuppressiva nehmen müssen. Ich hatte eine nierentransplantierte Frau auf meiner Station, die eine monatelang immer wieder aufflackernde Infektion hatte. Es ging trotz aller Therapieversuche nicht gut aus.
Dennoch: Die beiden Studien bringen uns bei der Erforschung von Long Covid ein gutes Stück weiter. Mal schauen, was die Wissenschaft uns Klinikern an zukünftigen Therapie daraus basteln wird.
